Què és la seqüenciació de l'exoma?
És una tècnica de seqüenciació massiva (NGS, next generation sequencing) que permet seqüenciar, de forma paral·lela, milions de fragments d’ADN, que cobreixen tots els gens (WES, whole exome sequencing)
Seqüenciació massiva: anàlisi de l'exoma
La seqüenciació de l’exoma complet (WES) aborda (gairebé) tots els gens d’una persona i és capaç d’identificar mutacions puntuals i altres tipus d’aberracions genètiques (com ara insercions i delecions) a l’ADN.
Igual que passa amb la seqüenciació del genoma, la seva utilitat clínica és cada cop més popular. Així, per exemple, estudis recents informen d’una taxa d’èxit en el diagnòstic de malalties rares propera al 25%.
Avantatges i desavantatges de l'anàlisi de l'exoma
Avantatges de la seqüenciació de l'exoma complet:
Els avantatges d’aquesta tècnica són:
- Proporciona una visió d’alta resolució, base per base, de l’exoma.
- Es poden detectar variants d’un sol nucleòtid i insercions/delecions.
- Obtenció de dades més ràpida que amb lanàlisi del genoma. Generalment s’obtenen “només” al voltant de 25.000 variants per analitzar. És a dir, menys dades per ser filtrats, investigats i emmagatzemats.
- Actualment, la major part de les mutacions puntuals conegudes associades a malalties es troben a la regió codificant (exoma) de l’ADN.
Desavantatges de la seqüenciació de l'exoma complet:
- Detecció de CNVs (copy number variants) no tan fiable com la seqüenciació de l’exoma.
- Dificultat per detectar variants estructurals grans.
- No detecta variants a regions no codificants.
Aplicacions clíniques de l'anàlisi de l'exoma complet
L'anàlisi de l'exoma completa inclou múltiples aspectes de la salut:
- Identificar malalties monogèniques (com la talassèmia).
- Identificació de la possible causa en malalties rares.
- Identificar una predisposició a desenvolupar una malaltia poligènica (com la diabetis mellitus tipus 2).
- Identificar els portadors genètics de malalties recessives, com la fibrosi quística.
La importància d'una bona interpretació de les dades
La seqüenciació de l’exoma permet la identificació de moltes variants més (mutacions puntuals, insercions i delecions) que altres tècniques, encara que es desconegui el significat de part d’aquesta informació. Atès que no tots els canvis genètics afecten la salut, de vegades és difícil saber si les variants identificades estan implicades en la salut de la persona o malaltia d’interès. De vegades, una variant identificada s’associa amb un trastorn genètic diferent que encara no s’ha diagnosticat (el que s’anomena troballes incidentals o secundàries).
Per això, és imprescindible comptar amb un equip de professionals experts capaços d’interpretar les dades i donar resposta a les preguntes dels metges i els pacients.
Quines variants genètiques es poden detectar mitjançant un exoma?
Les aplicacions de la seqüenciació de l’exoma complet (WES, whole exome sequencing) són la detecció de canvis en un sol nucleòtid (SNV, single nucleotide variant o SNP, single nucleotide polymorphism) o mutacions puntuals i de petites variacions en el nombre de còpies tals com a petites insercions i delecions a les regions codificants (gens) de l’ADN.
Què indica la cobertura?
La intensitat de la cobertura (depth of coverage) indica el nombre de vegades que una base del genoma ha estat seqüenciada. Com més gran és la cobertura més gran és la fiabilitat del mètode. És a dir, es redueix el percentatge de falsos negatius i falsos positius, i és possible fins i tot detectar variants presents en mosaïcisme.
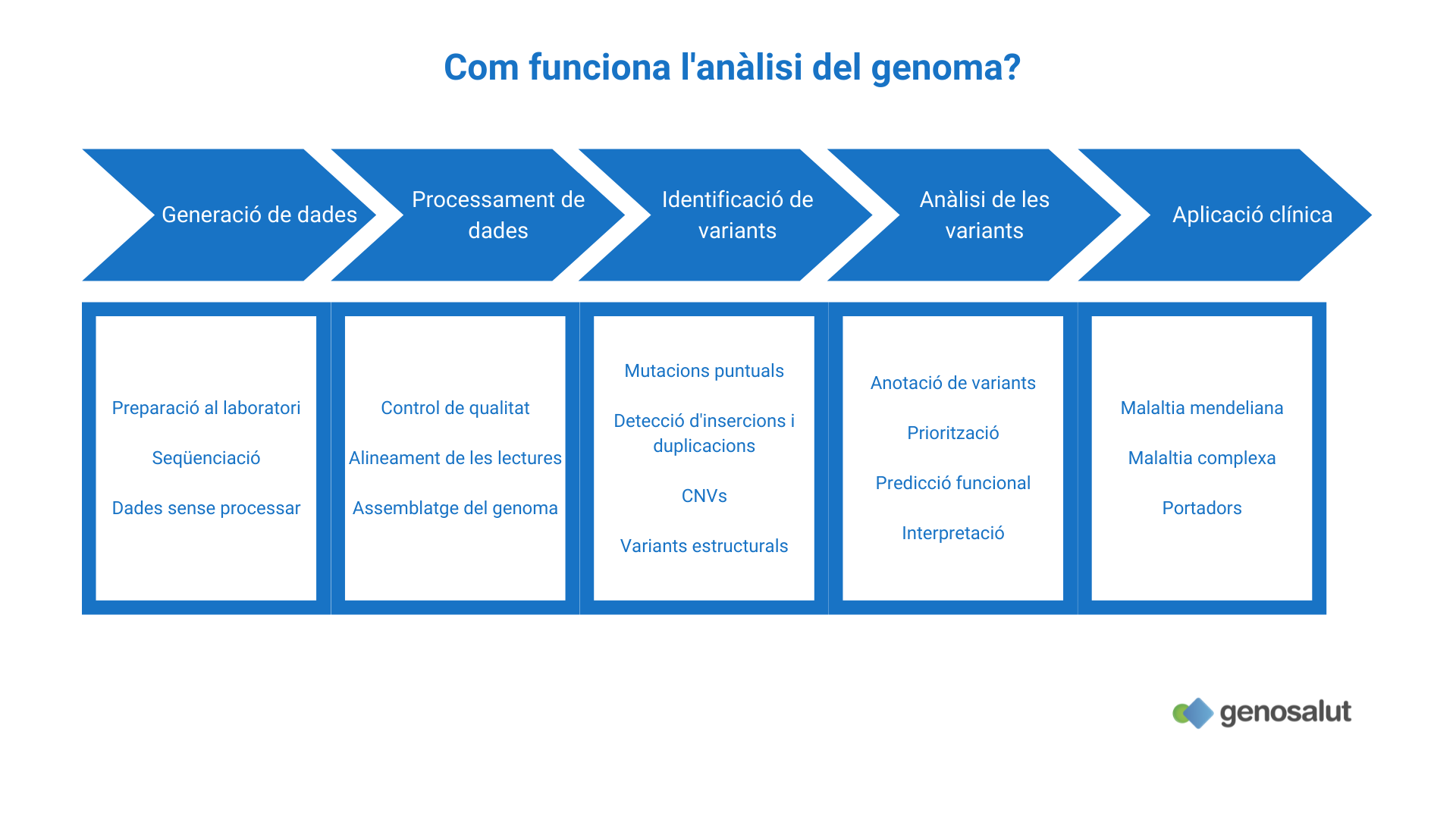
Com funciona la seqüenciació de l'exoma complet?
La seqüenciació de l’exoma és molt semblant a la seqüenciació del genoma. La principal diferència és que requereix un pas d’enriquiment de les regions codificants (gens) després de la preparació de les llibreries i abans de l’amplificació dels fragments.
És a dir, l’exoma ha de ser separat del genoma abans de la seqüenciació, ja que només contribueix a l’1% del total de l’ADN nuclear. La idea bàsica de l’enriquiment és separar qualsevol cosa d’interès d’altres substàncies fent servir la diferència de propietats fisicoquímiques entre si.
Hi ha dos mètodes principals per aconseguir l’enriquiment de l’exoma:
- Enriquiment de l’exoma basat en arrays. S’utilitzen sondes específiques unides a microarrays d’alta densitat per capturar l’exoma. Només aquells fragments d’ADN que tinguin una seqüència complementària quedaran units al microarray.
- Enriquiment de l’exoma en solució mitjançant sondes biotinil·lades. També en aquest cas només els fragments d’ADN que tinguin una seqüència complementària quedaran units a les sondes. El pool s’enriqueix a regions desitjades afegint microesferes d’estreptavidina que s’uneixen a les sondes biotinilades. Finalment, s’extreuen magnèticament les microesferes d’estreptavidina enriquides amb els fragments d’interès.
