¿Qué es la secuenciación del exoma?
Es una técnica de secuenciación masiva (NGS, next generation sequencing) que permite secuenciar, de forma paralela, millones de fragmentos de ADN, que cubren todos los genes (WES, whole exome sequencing)
Secuenciación masiva: análisis del exoma
La secuenciación del exoma completo (WES) aborda (casi) todos los genes de una persona, y es capaz de identificar mutaciones puntuales y otros tipos de aberraciones genéticas (tales como inserciones y deleciones) en el ADN.
Al igual que ocurre con la secuenciación del genoma, su utilidad clínica es cada vez más popular. Así por ejemplo, estudios recientes informan de una tasa de éxito en el diagnóstico de enfermedades raras próxima al 25%.
Ventajas y desventajas del análisis del exoma completo
Ventajas de la secuenciación del exoma completo:
Las ventajas de esta técnica son:
- Proporciona una visión de alta resolución, base por base, del exoma.
- Puede detectar variantes de un solo nucleótido e inserciones/deleciones.
- Obtención de datos más rápida que con el análisis del genoma. Generalmente se obtienen «sólo» alrededor de 25.000 variantes para analizar. Es decir, menos datos para ser filtrados, investigados y almacenados.
- En la actualidad, la mayor parte de las mutaciones puntuales conocidas asociadas a enfermedades se encuentran en la región codificante (exoma) del ADN.
Desventajas de la secuenciación del exoma completo:
- Detección de CNVs (copy number variants) no tan fiable como la secuenciación del exoma.
- Dificultad para detectar variantes estructurales grandes.
- No detecta variantes en regiones no codificantes.
Aplicaciones clínicas del análisis del exoma completo
El análisis del exoma completo abarca múltiples aspectos de la salud:
- Identificar enfermedades monogénicas (como la talasemia).
- Identificación de la posible causa en enfermedades raras.
- Identificar una predisposición a desarrollar una enfermedad poligénica (como la diabetes mellitus tipo 2).
- Identificar a los portadores genéticos de enfermedades recesivas, como la fibrosis quística.
La importancia de una buena interpretación de los datos
La secuenciación del exoma permite la identificación de muchas más variantes (mutaciones puntuales, inserciones y deleciones) que otras técnicas, aunque se desconozca el significado de parte de esta información. Dado que no todos los cambios genéticos afectan a la salud, en ocasiones es difícil saber si las variantes identificadas están implicadas en la salud de la persona o la enfermedad de interés. A veces, una variante identificada se asocia con un trastorno genético diferente que aún no se ha diagnosticado (lo que se denomina hallazgos incidentales o secundarios).
Por ello es imprescindible contar con un equipo de profesionales expertos capaces de interpretar los datos y dar respuesta a las preguntas de los médicos y los pacientes.
¿Qué variantes genéticas se pueden detectar mediante un exoma?
Las aplicaciones de la secuenciación del exoma completo (WES, whole exome sequencing) son la detección de cambios en un sólo nucleótido (SNV, single nucleotide variant o SNP, single nucleotide polymorphism) o mutaciones puntuales y de pequeñas variaciones en el número de copias tales como pequeñas inserciones y deleciones en las regiones codificantes (genes) del ADN.
¿Qué indica la cobertura?
La intensidad de la cobertura (depth of coverage) indica número de veces que una base del genoma ha sido secuenciada. Cuanto mayor es la cobertura mayor es la fiabilidad del método. Es decir, se reduce el porcentaje de falsos negativos y falsos positivos, y es posible incluso detectar variantes presentes en mosaicismo.
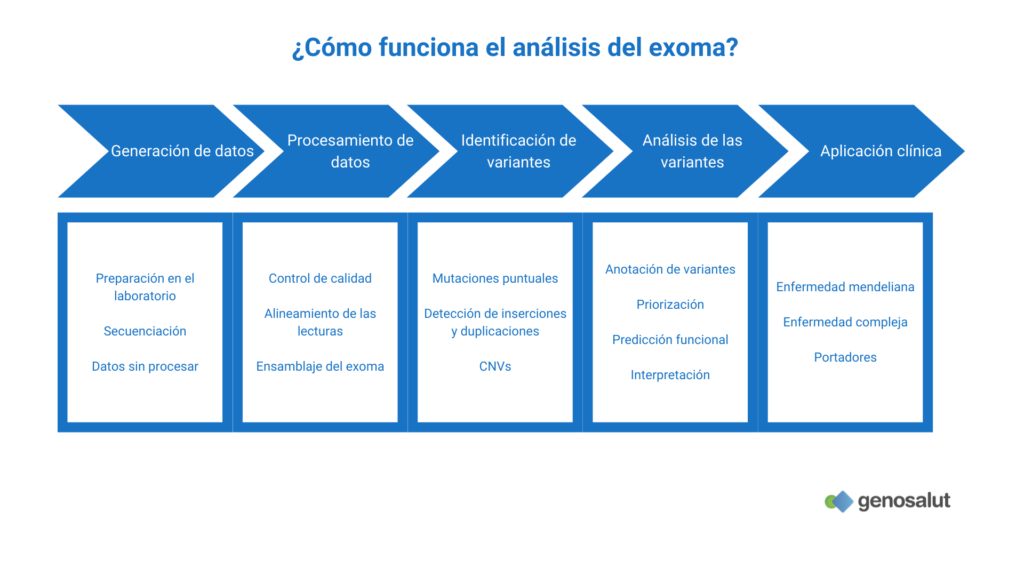
¿Cómo funciona la secuenciación del exoma completo?
La secuenciación del exoma es muy similar a la secuenciación del genoma. Su principal diferencia es que requiere un paso de enriquecimiento de las regiones codificantes (genes) tras la preparación de las librerías y antes de la amplificación de los fragmentos.
Es decir, el exoma tiene que ser «separado» del genoma antes de la secuenciación, ya que sólo contribuye al 1% del total del ADN nuclear. La idea básica del enriquecimiento es separar cualquier cosa de interés de otras sustancias utilizando la diferencia de propiedades fisicoquímicas entre ellas.
Existen dos métodos principales para lograr el enriquecimiento del exoma:
- Enriquecimiento del exoma basado en arrays. Utiliza sondas específicas unidas a microarrays de alta densidad para capturar el exoma. Sólo aquellos fragmentos de ADN que posean una secuencia complementaria quedarán unidos al microarray.
- Enriquecimiento del exoma en solución mediante sondas biotiniladas. También en este caso sólo aquellos fragmentos de ADN que posean una secuencia complementaria quedarán unidos a las sondas. El pool se enriquece regiones deseadas añadiendo microesferas de estreptavidina que se unen a las sondas biotiniladas. Finalmente, se extraen magnéticamentes las microesferas de estreptavidina enriquecidas con los fragmentos de interés.
