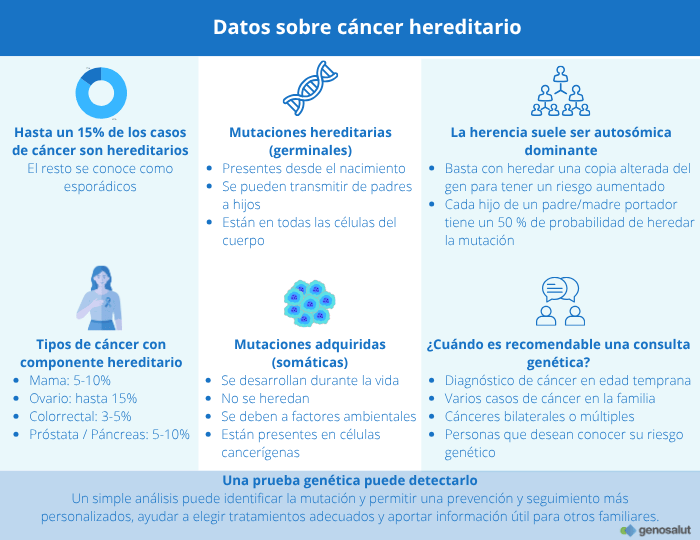
Muchas personas se preguntan si el cáncer puede transmitirse en la familia. La respuesta no es tan sencilla. El cáncer es una enfermedad compleja que puede tener múltiples causas. Si bien la mayoría de los casos se deben a factores ambientales o a mutaciones adquiridas a lo largo de la vida, en un pequeño porcentaje (entre el 5 % y el 10 %) existe una predisposición genética hereditaria.
Esta predisposición se debe a alteraciones genéticas presentes desde el nacimiento que pueden transmitirse de padres a hijos. Entender cuándo el cáncer tiene un componente hereditario es clave para adoptar medidas preventivas, mejorar el diagnóstico precoz y ofrecer un tratamiento más personalizado.
Cáncer y genética: cómo se produce la enfermedad
El cáncer se origina a partir de mutaciones genéticas que alteran los mecanismos normales de crecimiento y división celular. Estas mutaciones pueden provocar que las células no respondan a las señales de control, se dividan de manera descontrolada y formen tumores.
Existen dos tipos de mutaciones implicadas en el cáncer:
– Mutaciones somáticas o adquiridas: Son las más comunes. Se producen a lo largo de la vida debido a factores ambientales (tabaco, radiación, infecciones, dieta) o por errores espontáneos durante la división celular. No se heredan.
– Mutaciones germinales o hereditarias: Están presentes desde el nacimiento y se pueden transmitir a través del ADN de los padres. Afectan a todas las células del cuerpo y aumentan la predisposición genética a desarrollar ciertos tipos de cáncer.
El cuerpo humano cuenta con múltiples mecanismos para reparar el ADN dañado, pero cuando estos fallan, los errores se acumulan, favoreciendo la aparición de tumores. En los cánceres hereditarios, la mutación germinal ya existente hace que las células partan con una alteración previa en un gen clave, lo que reduce el número de cambios necesarios para que se inicie el proceso tumoral.
La diferencia entre el cáncer hereditario y el cáncer esporádico
Aunque todos los tipos de cáncer tienen un mismo origen biológico —mutaciones que alteran el ADN de las células—, no todas esas mutaciones aparecen del mismo modo ni tienen las mismas consecuencias.
La gran mayoría de los cánceres son esporádicos, lo que significa que surgen a lo largo de la vida debido a una combinación de factores ambientales, hábitos de vida y procesos naturales de envejecimiento celular. En estos casos, las mutaciones se adquieren progresivamente en células concretas del organismo y no se transmiten a la descendencia. Por eso, suelen diagnosticarse en edades más avanzadas y no existe un patrón claro de repetición dentro de la familia.
En cambio, los cánceres hereditarios aparecen cuando una persona hereda una mutación germinal, es decir, una alteración genética presente en todas las células del cuerpo desde el nacimiento. Esta mutación afecta a genes clave implicados en la reparación del ADN, el control del crecimiento celular o la apoptosis (muerte celular programada). Al ser heredada de uno de los progenitores, puede transmitirse de generación en generación, lo que provoca que estos cánceres aparezcan con mayor frecuencia dentro de una misma familia y, a menudo, a edades más tempranas que los esporádicos.
Detectar una mutación hereditaria no significa que la persona vaya a desarrollar un cáncer con certeza, pero sí implica una predisposición significativamente mayor. Por eso, las personas con antecedentes familiares relevantes deberían considerar la posibilidad de realizar pruebas genéticas para conocer su riesgo y optar, si es necesario, por estrategias de vigilancia o prevención personalizadas.
Principales tipos de cáncer con componente hereditario
Como se ha mencionado anteriormente, en estos casos, la persona nace con una mutación germinal que incrementa su predisposición a desarrollar determinados tipos de cáncer. Estas mutaciones se transmiten a través del ADN familiar, por lo que pueden afectar a varios miembros de una misma familia y repetirse en distintas generaciones.
A continuación, se describen los tipos de cáncer más habitualmente relacionados con mutaciones hereditarias:
Cáncer colorrectal hereditario
Entre el 3 % y el 5 % de los cánceres colorrectales tienen un origen hereditario, es decir, están causados por una mutación germinal que aumenta el riesgo de desarrollar tumores en el colon o el recto.
El más frecuente es el síndrome de Lynch, pero existen otras formas hereditarias que también deben tenerse en cuenta.
Síndrome de Lynch
Causado por mutaciones en los genes MLH1, MSH2, MSH6, PMS2 o EPCAM, el síndrome de Lynch es la forma más común de cáncer colorrectal hereditario. Aumenta el riesgo de cáncer de colon y recto, así como de endometrio, ovario, estómago y vías urinarias.
Conoce más sobre el Síndrome de Lynch en este artículo.
Otras formas hereditarias
No todos los cánceres colorrectales hereditarios son síndrome de Lynch. Otras causas incluyen la poliposis adenomatosa familiar (PAF), debida a mutaciones en el gen APC, y la poliposis asociada a MUTYH (MAP), con un patrón autosómico recesivo. Además, se han identificado mutaciones menos comunes en genes como POLE, POLD1, NTHL1 o MSH3, implicados en la reparación o replicación del ADN.
Cáncer de mama, ovario y endometrio hereditario (genes BRCA y otros)
Entre el 5 % y el 10 % de los casos de cáncer de mama y hasta un 15 % de los de ovario tienen un origen hereditario, causado por mutaciones en genes que aumentan la predisposición al cáncer.
Los más conocidos son BRCA1 y BRCA2, responsables de la reparación del ADN. Cuando están alterados, las células acumulan daños genéticos que incrementan el riesgo de desarrollar tumores. Las personas portadoras de estas mutaciones presentan un riesgo mayor de cáncer de mama y ovario, tanto en mujeres como en hombres, y también un riesgo aumentado de cáncer de próstata, páncreas y, en algunos casos, melanoma.
Sin embargo, no todos los cánceres hereditarios de mama, ovario o endometrio se deben a BRCA. Otros genes implicados incluyen PALB2, RAD51C, RAD51D, BRIP1, CHEK2, ATM, TP53, PTEN y los genes MMR (MLH1, MSH2, MSH6, PMS2, EPCAM), asociados al síndrome de Lynch, que también puede causar cáncer de endometrio y ovario.
Cáncer de próstata y páncreas
Aunque la mayoría de los casos de cáncer de próstata y cáncer de páncreas son esporádicos, entre un 5 % y un 10 % pueden tener un origen hereditario.
En muchos de estos casos, las mutaciones responsables afectan a genes que también se relacionan con otros tipos de cáncer, como los BRCA1 y BRCA2, conocidos por su papel en el cáncer de mama y ovario. Las mutaciones en BRCA2 confieren el mayor riesgo hereditario de cáncer de próstata, especialmente en hombres que desarrollan la enfermedad antes de los 60 años o que presentan antecedentes familiares directos. También se han identificado mutaciones en ATM, CHEK2, HOXB13 y PALB2, que incrementan la susceptibilidad.
En el caso del cáncer de páncreas, las mutaciones en los genes BRCA1, BRCA2, PALB2, CDKN2A y STK11 están implicadas en una fracción significativa de los casos familiares.
El síndrome de Lynch también puede aumentar el riesgo de este tumor.
Cáncer de tiroides y otros tumores endocrinos
El cáncer de tiroides puede formar parte de distintos síndromes genéticos hereditarios, especialmente cuando aparece a edades tempranas o se presenta en varios miembros de una misma familia.
Uno de los más conocidos es el síndrome de neoplasia endocrina múltiple tipo 2 (MEN2), causado por mutaciones en el gen RET.
Este síndrome predispone al desarrollo de carcinoma medular de tiroides, así como de feocromocitomas y, en algunos casos, tumores de paratiroides.
La detección de una mutación en RET permite actuar de forma preventiva, llegando incluso a recomendar la tiroidectomía profiláctica en familiares portadores antes de que aparezca el cáncer.
Por otro lado, las mutaciones en el gen PTEN —causantes del síndrome de Cowden— aumentan el riesgo de cáncer de tiroides (sobre todo de tipo folicular), así como de mama, endometrio y riñón.
Existen también síndromes más raros, como las neoplasias endocrinas múltiples tipo 1 y tipo 4 (MEN1, MEN4), debidas a alteraciones en los genes MEN1 y CDKN1B, que predisponen a tumores en paratiroides, páncreas endocrino y glándula pituitaria.
Cánceres múltiples o en edades tempranas
Cuando una persona desarrolla más de un tipo de cáncer a lo largo de su vida, o lo hace a edades inusualmente jóvenes, puede existir una predisposición genética subyacente.
El ejemplo más representativo es el síndrome de Li-Fraumeni, causado por mutaciones en el gen TP53, que afecta a un amplio espectro de tumores: sarcomas, cáncer de mama, leucemias, tumores cerebrales y adrenocorticales, entre otros. En estos casos, el cáncer suele aparecer en la infancia o la juventud, y puede repetirse en distintas generaciones familiares.
Otros genes también asociados a cánceres múltiples incluyen PTEN, STK11, CDKN2A, SDHB y SDHD, implicados en síndromes que predisponen a tumores en distintos órganos.
¿Cómo se hereda el cáncer?
En los cánceres hereditarios, el riesgo de desarrollar la enfermedad se transmite a través de mutaciones genéticas que pueden pasar de padres a hijos.
Estas mutaciones no causan cáncer por sí solas, pero aumentan la predisposición a que se desarrolle con mayor facilidad a lo largo de la vida.
Herencia autosómica dominante
La mayoría de los síndromes de cáncer hereditario siguen un patrón de herencia autosómico dominante.
Esto significa que basta con heredar una sola copia alterada del gen —procedente de uno de los progenitores— para tener un riesgo elevado de desarrollar la enfermedad. En este caso, cada hijo o hija tiene un 50 % de probabilidad de heredar la mutación.
Sin embargo, heredar la mutación no implica necesariamente que la persona vaya a desarrollar cáncer. La aparición de la enfermedad depende también de factores ambientales, hábitos de vida y otros genes que pueden aumentar o reducir el riesgo.
Otros patrones de herencia
Existen también formas menos frecuentes de herencia:
– Autosómica recesiva: se necesitan dos copias alteradas del gen (una de cada progenitor) para que aumente el riesgo de cáncer. Este es el caso, por ejemplo, de la poliposis asociada a MUTYH (MAP).
– Ligada al cromosoma X: la mutación se localiza en el cromosoma X, por lo que puede afectar de manera diferente a hombres y mujeres. Este patrón es menos común, pero se ha descrito en algunos síndromes raros de predisposición al cáncer.
Genes implicados en el cáncer hereditario
Los genes relacionados con el cáncer hereditario se agrupan, de forma general, en tres grandes categorías según su función dentro de la célula:
– Genes supresores de tumores
Son los encargados de controlar el crecimiento celular y reparar el ADN dañado. Cuando dejan de funcionar correctamente, las células pueden dividirse sin control. Ejemplos destacados son TP53, BRCA1, BRCA2 y APC.
– Genes reparadores del ADN
Corrigen los errores que se producen de manera natural durante la replicación del material genético. Las mutaciones en estos genes —como MLH1, MSH2, MSH6, PMS2 o EPCAM— son responsables del síndrome de Lynch y de otros cánceres hereditarios.
– Genes protooncogénicos
En condiciones normales, estos genes estimulan el crecimiento y la división celular cuando es necesario. Sin embargo, cuando mutan, se transforman en oncogenes, lo que puede llevar a una proliferación descontrolada. Ejemplos son RET, MET y KIT, implicados en algunos cánceres endocrinos y gástricos.
Cuando una persona hereda una copia alterada de uno de estos genes, sus células parten con una desventaja genética: basta con que la segunda copia del gen se dañe para perder por completo la función protectora. Este fenómeno, descrito por el investigador Alfred Knudson en 1971, se conoce como la “hipótesis de los dos golpes” (two-hit hypothesis), y explica por qué las personas portadoras de mutaciones hereditarias desarrollan cáncer con mayor probabilidad o a edades más tempranas.
La importancia de las pruebas genéticas
Las pruebas genéticas son una herramienta fundamental para identificar si una persona presenta mutaciones hereditarias que aumentan su riesgo de desarrollar cáncer.
A través de una muestra sencilla de sangre o saliva, es posible analizar los genes asociados a síndromes de cáncer hereditario y detectar variantes que puedan tener implicaciones clínicas.
Avances en diagnóstico genético
En los últimos años, los progresos en genética y biotecnología han permitido desarrollar paneles de diagnóstico multigénico cada vez más amplios y precisos, capaces de analizar simultáneamente decenas de genes asociados al cáncer hereditario.
Estos estudios ayudan a establecer planes de prevención y seguimiento más eficaces, adaptados al perfil genético de cada persona y familia.
¿Quién debería considerar una prueba genética?
Las pruebas genéticas no están indicadas para toda la población, sino para personas con ciertas características que sugieren un posible origen hereditario del cáncer, como:
– Diagnóstico de cáncer a edades tempranas, por ejemplo, cáncer de mama antes de los 40 años o cáncer colorrectal antes de los 50.
– Presencia de varios casos del mismo tipo de cáncer (mama, colon, ovario, endometrio, etc.) en diferentes generaciones de una misma familia.
– Cánceres bilaterales o múltiples, como cáncer en ambos senos, ambos riñones o tumores distintos en una misma persona.
– Familiares diagnosticados con síndromes hereditarios conocidos (como síndrome de Lynch, BRCA, Li-Fraumeni o poliposis adenomatosa familiar).
– Cáncer en órganos poco frecuentes o en edades inusualmente jóvenes (por ejemplo, cáncer de páncreas o tiroides antes de los 50 años).
– Personas con antecedentes familiares de cáncer en ambos linajes, paterno y materno, o con varios familiares afectados a edades similares.
– Pacientes con resultados tumorales compatibles con una mutación germinal, como inestabilidad microsatelital o pérdida de expresión de proteínas reparadoras del ADN en el estudio del tumor.
– Personas que desean conocer su riesgo genético.
Ventajas del diagnóstico genético
Realizar un estudio genético puede ofrecer múltiples beneficios tanto para la persona afectada como para su familia:
– Prevención personalizada: permite establecer estrategias de seguimiento adaptadas, como colonoscopias, mamografías o revisiones ginecológicas más tempranas y frecuentes.
– Toma de decisiones informada: ayuda a valorar opciones preventivas o reproductivas, incluyendo la cirugía profiláctica o el diagnóstico genético preimplantacional.
– Tratamientos dirigidos: algunos fármacos específicos, como los inhibidores de PARP, son eficaces únicamente en pacientes con mutaciones en los genes BRCA1 o BRCA2.
El asesoramiento genético, antes y después de la prueba, es esencial para interpretar correctamente los resultados, comprender su significado y tomar decisiones informadas sobre el cuidado personal y familiar.
Cáncer hereditario y prevención
Detectar una predisposición genética al cáncer no significa que la enfermedad sea inevitable.
Al contrario, conocer esta información ofrece una gran oportunidad para prevenirla o detectarla de forma temprana, cuando los tratamientos son más eficaces.
Estrategias de prevención y seguimiento
Las medidas recomendadas varían según el tipo de mutación y la historia personal o familiar, pero en general incluyen:
– Controles médicos periódicos y personalizados, adaptados al tipo de gen alterado y al riesgo de cada persona (mamografías, colonoscopias, ecografías, resonancias, etc.).
– Estilo de vida saludable, con una dieta equilibrada, práctica regular de ejercicio físico y evitando el tabaco y el consumo excesivo de alcohol.
– Tratamientos preventivos o profilácticos, como la quimioprevención o, en casos de alto riesgo, la cirugía preventiva para reducir la probabilidad de desarrollar determinados tumores.
– Apoyo psicológico y asesoramiento familiar, esenciales para acompañar el proceso de toma de decisiones y reducir el impacto emocional de los resultados genéticos.
Conclusión
El cáncer hereditario constituye una fracción relevante de todos los casos de cáncer, y su impacto en las familias, así como en las estrategias de prevención, es considerable. Conocer la base genética de la enfermedad permite actuar de forma anticipada, mejorar el diagnóstico y ofrecer tratamientos personalizados, ajustados al riesgo específico de cada persona.
La genética médica no solo contribuye a comprender las causas del cáncer, sino que también impulsa una medicina más preventiva, precisa y humana, en la que el conocimiento científico y el acompañamiento profesional se combinan para proteger la salud y el bienestar de las personas y sus familias.
En Genosalut, acompañamos a quienes desean conocer y gestionar su riesgo genético. Nuestro equipo ofrece asesoramiento especializado y pruebas genéticas personalizadas, con el objetivo de proporcionar información rigurosa que permita tomar decisiones fundamentadas y preservar la salud a largo plazo.
¿Tienes antecedentes familiares de cáncer o dudas sobre tu riesgo genético?
En Genosalut te ofrecemos asesoramiento personalizado y pruebas genéticas adaptadas a tu situación.
Pide tu cita aquí y da el primer paso hacia una prevención informada.