Què és l’azoospèrmia?
Els metges parlen d’azoospèrmia quan no es troben espermatozoides al semen. Els homes amb azoospèrmia són infèrtils. Tot i això, els afectats no han d’abandonar per complet el seu desig de ser pares, hi ha procediments que fan possible aconseguir un embaràs, com ara la teràpia hormonal o la realització d’una biòpsia testicular per a l’extracció d’espermatozoides que poden ser utilitzats per a la reproducció assistida.
A continuació, us expliquem tot el que necessiteu saber sobre l’azoospèrmia: diagnòstic, causes i opcions de tractament.
Quants homes pateixen azoospèrmia?
Pel que fa als números, s’estima que afecta fins a l’1% de tots els homes i entre el 10% i el 15% dels homes de les parelles infèrtils.
Quins són els símptomes de l’azoospèrmia?
Per norma general, l’azoospèrmia és un trastorn que no presenta cap símptoma perceptible. Els homes afectats no solen tenir queixes i només quan sorgeix el desig de tenir un fill i no es compleix, s’adonen que alguna cosa va malament.
No obstant això, en alguns homes, un problema de base, com ara una anomalia cromosòmica, un desequilibri hormonal, venes testiculars dilatades o una afecció que obstrueix el pas dels espermatozoides sí que poden causar certs signes i símptomes. Així, per exemple, els homes amb síndrome de Klinefelter (que en un 90% dels casos pateixen azoospèrmia) poden tenir una sèrie de problemes generals de salut com ara: síndrome metabòlica, malalties autoimmunes, tromboembolismes, trastorns cognitius o psiquiàtrics…
Com es diagnostica l’azoospèrmia?
En qualsevol cas, per al diagnòstic de l’azoospèrmia cal en primer lloc fer un espermiograma o seminograma. Aquesta prova permet analitzar detalladament el contingut seminal i determinar la qualitat de l’esperma (concentració, quantitat, morfologia i mobilitat dels espermatozoides). És un primer examen a l’hora de valorar la infertilitat masculina, però en cap cas és un test definitiu de fertilitat.
Pel que fa a la concentració dels espermatozoides, els valors es comparen amb aquells de referència de l’Organització Mundial de la Salut (OMS) i s’estableix un diagnòstic:
● Azoospèrmia: no es troben espermatozoides a la mostra fresca i tampoc després de centrifugació de la mateixa.
● Criptozoospèrmia: no es troben espermatozoides a la mostra fresca però sí després de centrifugació de la mateixa.
● Oligospèrmia: la concentració d’espermatozoides a l’ejaculat és inferior a 15 milions per mil·lilitre.
● Normozoospèrmia: cap paràmetre seminal alterat. La mostra seminal és dins de la normalitat.
Per poder diagnosticar l’azoospèrmia amb seguretat i evitar errors analítics, l’OMS recomana fer dos seminogrames amb dos-tres mesos d’interval entre l’un i l’altre. D’aquesta manera, es pot descartar que l’absència d’espermatozoides a la primera mostra es deu a factors com estrès, mala alimentació, presa de medicaments, febre, etc. Si al segon seminograma el resultat del recompte d’espermatozoides és de nou zero, es confirma el diagnòstic d’azoospèrmia.
Quins són els tipus d’azoospèrmia?
L’azoospèrmia sol classificar-se en dos grans grups:
● Azoospèrmia secretora o no obstructiva: quan hi ha problemes hormonals o funcionals dels testicles a l’hora de produir espermatozoides (espermatogènesi).
● Azoospèrmia obstructiva: quan es produeixen espermatozoides, però no poden ser expulsats a l’ejaculat per una obstrucció o absència dels conductes que surten dels testicles.
Pel que fa a les causes, són diverses les que s’amaguen darrere de l’azoospèrmia. A grans trets, es pot tractar d’una azoospèrmia congènita (és a dir, que es pateix des del naixement, bé per causes genètiques o altres) o adquirida (generalment per factors externs com substàncies tòxiques, fàrmacs, traumatismes…) De vegades, no és possible identificar la causa i es parla d’azoospèrmia idiopàtica.
A continuació, us detallem les principals causes de l’azoospèrmia no obstructiva i l’azoospèrmia obstructiva.
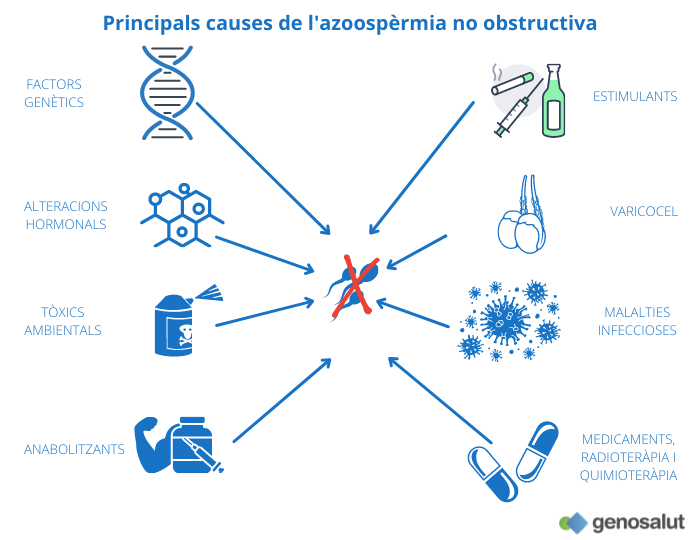
Quines són les causes principals de l’azoospèrmia secretora o no obstructiva?
Les causes de l’azoospèrmia no obstructiva són variades i van des d’alteracions hormonals fins a danys orgànics i alteracions genètiques. Entre els desencadenants es troben:
● Anomalies genètiques: microdelecions del cromosoma Y, anomalies cromosòmiques numèriques (síndrome de Klinefelter), anomalies cromosòmiques estructurals (alteracions al cromosoma Y amb cromosomes I isodicèntrics, truncats o en anell o anomalies , síndrome de l’home 46, XX, mutacions en determinats gens (CFTR, ADGRG2, AR, TEX11…)
● Estimulants com l’alcohol, les cigarretes o les drogues.
● Tòxics ambientals com pesticides, metalls pesants o dissolvents.
● Tractaments contra el càncer (radioteràpia i quimioteràpia).
● Determinats fàrmacs, com, per exemple, la cimetidina i la sulfasalazina.
● Consum d’anabolitzants.
Tots els homes que volen accentuar la seva força muscular prenent esteroides anabòlics han de tenir en compte que aquestes substàncies provoquen una forta disminució de l’autoproducció de les hormones necessàries per a la producció d’espermatozoides (FSH i LH), cosa que comporta una disminució de la producció de els mateixos. Fins i tot després d’anys d’abús, l’única cosa que ajuda és la medicació per potenciar les hormones.
● Malalties sistèmiques greus com, per exemple, la insuficiència renal o hepàtica severa.
● Infeccions com el virus de les galteres que poden provocar la inflamació dels testicles (orquitis). Aquesta inflamació pot perjudicar temporalment o permanentment el desenvolupament dels espermatozoides.
● Varicocel sever.
● Alteracions hormonals, com l’hipogonadisme hipogonadotrop (deficiència de les hormones alliberades per la hipòfisi i encarregades d’estimular la producció espermàtica als testicles). Pot ser degut a una alteració congènita (síndrome de Kallman), a un tumor hipofisari, o a la presa d’esteroides anabolitzants que suprimeixen la funció hipofisària.
● Absència congènita de testicles (anòrquia).
● Anomalies del descens dels testicles (criptorquídia) durant el desenvolupament embrionari, que queden amagats a l’engonal oa l’abdomen. Normalment es detecta en néixer i se sol operar a una edat primerenca. No obstant això, a les criptorquídies bilaterals la majoria dels homes són azoospèrmics malgrat haver-se sotmès a l’operació.
● Idiopàtica: de causa desconeguda.
Quines són les principals causes de l’azoospèrmia obstructiva?
En aquest tipus d’azoospèrmia els testicles funcionen correctament, però els espermatozoides no poden arribar a l’ejaculat. Perquè hi hagi una azoospèrmia es requereix una obstrucció bilateral de la via seminal, bé sigui per causes congènites o adquirides (infeccions, operacions, traumatismes).
● Obstrucció de tots dos conductes deferents: congènita (ABCD, agenèsia bilateral de conductes deferents) o adquirida (vasectomia, cirurgia bilateral d’hèrnia inguinal, determinades infeccions com la gonorrea).
● Obstrucció d’ambdós conductes ejaculadors: congènita (quists müllerians) o adquirida (després d’una prostatitis).
● Obstrucció de tots dos epidídims: congènita o adquirida (després d’una epididimitis, d’un traumatisme o de cirurgia escrotal).
Com es diagnostica el tipus d’azoospèrmia?
Un cop establert el diagnòstic d’azoospèrmia sobre la base dels resultats del seminograma, hi ha altres proves i anàlisis que poden servir per determinar el tipus concret d’azoospèrmia, secretora o obstructiva. Entre ells hi ha: l’anamnesi, l’anàlisi hormonal, l’exploració física, l’estudi genètic i la biòpsia testicular.
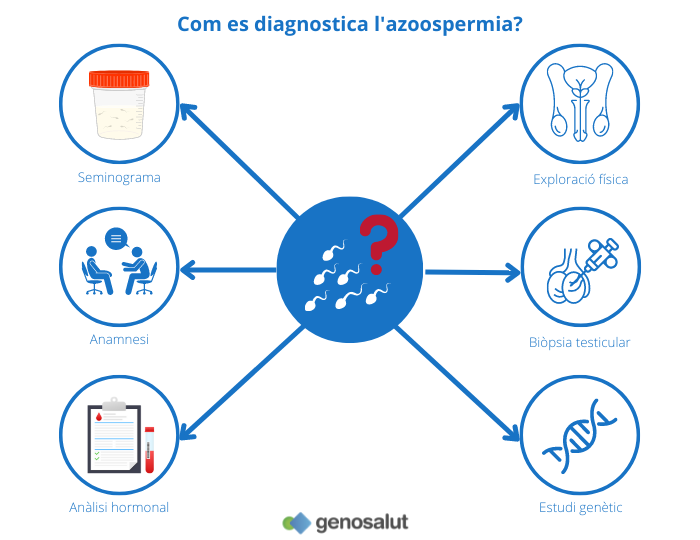
Anamnesi o història clínica
Si bé l’anamnesi es fa al principi d’una consulta per problemes de fertilitat, un cop es té el resultat d’azoospèrmia sobre la base del seminograma, es pot ratificar, aprofundir o completar amb preguntes adreçades a aquest tipus d’afecció. Aquestes preguntes faran referència a: tractaments amb radioteràpia o quimioteràpia, exposició a pesticides i toxines, presa d’esteroides anabolitzants, haver patit determinades malalties (virus de les galteres, tumor testicular, MTS, varicocele, hidrocel…), traumatismes als testicles, historial de fertilitat a la família…
Anàlisi hormonal
La producció d’espermatozoides està regulada per hormones, entre les quals hi ha la testosterona i la FSH (hormona fol·liculoestimulant). Alteracions en l’equilibri del sistema endocrí (hormonal) poden alterar l’espermatogènesi i impedir l’alliberament d’espermatozoides. De la mateixa manera, alteracions en l’espermatogènesi poden causar desequilibris hormonals.
L’anàlisi d’aquestes dues hormones pot servir, de vegades, per determinar el tipus d’azoospèrmia.
● FSH: Aquesta hormona es produeix a la hipòfisi (glàndula de la base del cervell) i la seva funció principal és estimular la producció d’espermatozoides al testicle.
Errors en l’espermatogènesi provoquen l’augment de la FSH com a resposta de l’organisme en un intent d’estimular més els túbuls seminífers per restablir la normalitat. A les azoospèrmies no obstructives el valor de la FSH pot estar elevat, a les azoospèrmies obstructives el valor de la FSH sol ser normal, i en algunes malalties de la hipòfisi la FSH està disminuïda (com l’hipogonadisme hipogonadotrop).
● Testosterona: Aquesta hormona, produïda al testicle, segueix el patró contrari a la FSH. En cas de fallades en l’espermatogènesi (azoospèrmia), els pacients presenten nivells de testosterona més baixos del que és habitual.
Valors alts de FSH i baixos de testosterona són indicatius d’azoospèrmia no obstructiva o secretora. És a dir, l’absència d’espermatozoides es deu a la manca de producció dels mateixos, a alteracions a l’espermatogènesi.
Per contra, valors hormonals normals són indicatius d’azoospèrmia obstructiva. Generalment, l’obstrucció apareix a nivell d’epidídim o dels conductes deferents.
Exploració física
L’exploració física inclou la palpació dels testicles (per buscar embalums i avaluar-ne la mida i la posició), dels epidídims, i dels conductes deferents. També cal descartar la presència d’un varicocele de mida significativa.
No obstant això, la distinció entre azoospèrmia no obstructiva i obstructiva és difícil sobre la base dels exàmens esmentats. Ni l’exploració física (palpació dels conductes deferents i mesurament del volum testicular) ni les anàlisis de laboratori (nivells hormonals) o una combinació permeten establir amb seguretat el diagnòstic.
Si els resultats no són concloents o si no es troba cap d’aquestes troballes addicionals, és impossible saber si es tracta d’una azoospèrmia obstructiva o no obstructiva. El diagnòstic el proporciona una biòpsia testicular.
Biòpsia testicular
En els homes amb azoospèrmia, el diagnòstic definitiu (encara que merament descriptiu i no causal) només es pot determinar mitjançant una biòpsia testicular, que sol realitzar-se (mitjançant extracció d’esperma testicular, TESE o microTESE) en el mateix acte quirúrgic que l’obtenció de espermatozoides per a fecundació in vitro (FIV).
Els resultats que es poden obtenir són els següents:
● Atròfia mixta: túbuls amb diferents estadis d’espermatogènesi.
● Diversos tipus de bloqueig durant l’espermatogènesi: bloqueig meiòtic, espermàtida rodona…
● Síndrome de Sertoli (SCOS, Sertoli Cell Only Syndrome) en què els túbuls no contenen cap cèl·lula germinal.
Aquests fenotips poden ser globals (presents a tots els túbuls) o focals, amb un percentatge variable de túbuls que mostren diverses etapes d’espermatogènesi limitada a nivell quantitatiu i qualitatiu.
Com hem indicat, totes les categories són descriptives. És a dir, simplement ajuden a classificar el factor masculí en la infertilitat de la parella, però no ofereixen cap diagnòstic causal de l’alteració de l’espermatogènesi o de les causes d’obstrucció en els homes afectats.
Per determinar la causa de l’azoospèrmia, una eina valuosa són les diferents anàlisis genètiques, en concret els estudis genètics avançats com l’exoma i el genoma.
Estudi genètic clàssic
El diagnòstic genètic en pacients azoospèrmics s’ha estancat des de fa dècades en uns estudis bàsics. Tot i que ofereixen una resposta en aprox. el 20% dels casos, se sap actualment que la influència de la genètica en aquest tipus de pacients és molt més gran.
Fins ara, les proves genètiques indicades en casos d’azoospèrmia solen ser:
● Cariotip: per descartar la síndrome de Klinefelter.
Els homes amb síndrome de Klinefelter tenen, per norma general, un cromosoma X extra, és a dir, el seu cariotip és 47, XXY. Tot i això, també hi ha casos amb 2 o 3 cromosomes X extra (48, XXXY i 49, XXXXY respectivament). La freqüència estimada d’aquesta síndrome és d’1 de cada 600 homes a la població general, mentre que en els pacients amb azoospèrmia no obstructiva arriba a ser d’1 de cada 7. Són homes amb testicles petits i ferms, més del 90% pateixen azoospèrmia i la resta criptozoospèrmia o oligospèrmia severa.
La possibilitat de ser pares per a aquests pacients depèn en gran mesura de dos factors: l’edat i el grau de mosaïcisme. Les tècniques de reproducció assistida (TESE i especialment micro-TESE) permeten recuperar espermatozoides testiculars en pacients amb síndrome de Klinefelter que són azoospèrmics, i les taxes d’èxit són millors en els homes menors de 31 anys.
● Estudi de les microdelecions del cromosoma Y: per descartar la presència de delecions a la regió AZF.
Els homes poden presentar des d’una oligospèrmia severa fins a una azoospèrmia en funció de la localització i de l’extensió del fragment perdut. Tot i això, fins i tot en els casos d’azoospèrmia, els homes afectats poden tenir fills biològics mitjançant TESE seguit d’ICSI. Cal tenir en compte, que la deleció es transmetrà obligatòriament als fills homes i que per tant també hauran de recórrer a tècniques de fecundació assistida per ser pares.
Atès que s’ha descrit una disminució progressiva de la producció d’esperma en els homes amb síndrome de Klinefelter i deleció d’AZFc, la criopreservació preventiva d’espermatozoides a l’edat adulta jove és una opció viable per a la preservació de la fertilitat.
● Mutacions al gen CFTR: els casos d’azoospèrmia obstructiva són deguts en fins a un 80% dels casos a l’absència de conductes deferents la causa és una mutació al gen CFTR. Pràcticament el 100% d’aquests pacients poden ser pares extraient els espermatozoides del testicle o epidídim i fent-los servir amb fecundació in vitro.
Això no obstant, atès que la freqüència de portadors de mutacions de CFTR en persones d’ascendència europea és elevada (1 de cada 25), és obligatori el cribratge de la parella per avaluar el risc de donar a llum un nen afectat per la fibrosi quística. Si tots dos progenitors són portadors, cal fer un diagnòstic prenatal o un DGP.
Com hem indicat al principi d’aquest apartat, ja és sabut que la influència de la genètica en la infertilitat masculina és molt més gran. És a dir, amb els estudis genètics clàssics molts pacients azoospèrmics mai no coneixeran la causa de la seva afecció. De vegades, per donar resposta a la causa del problema de fertilitat, pot servir la realització d’un estudi genètic avançat.
Estudi genètic avançat
Els avenços tecnològics i científics dels darrers anys han permès identificar més de 100 mutacions genètiques associades amb infertilitat i azoospèrmia. Per això, la realització d’una anàlisi genètica global, com l’exoma o el genoma, que detecti tant els factors genètics “clàssics” estudiats fins ara (síndrome de Klinefelter, microdelecions del cromosoma Y, mutacions al gen CTFR), com les noves mutacions detectades en els darrers anys és una eina que pot contribuir a la determinació de la causa de l’azoospèrmia.
A banda de la seva implicació directa en la fertilitat del pacient, el coneixement de les causes genètiques de la infertilitat és important per altres motius:
● Les variants genètiques implicades en la infertilitat masculina també poden afectar la salut general.
● Les variants genètiques relacionades amb infertilitat poden tenir implicacions per a la salut reproductiva i general de la descendència.
● Millora la presa de decisions clíniques: Mutacions en determinats gens ja tenen un valor pronòstic per a la recuperació d’esperma testicular. Per exemple, mutacions al gen TEX11 estan associades a cap èxit en la recuperació d’espermatozoides mitjançant TESE o micro-TESE.
● La identificació d’algunes variants genètiques pot ajudar a personalitzar les teràpies hormonals (farmacogenètica) en un futur proper
● Millora el consell genètic: Permet recomanar el tractament més indicat per aconseguir un embaràs d’èxit
A Genosalut tenim més de 10 anys d’experiència en la realització i la interpretació d’exomes i genomes per al diagnòstic clínic.
Un home amb azoospèrmia és capaç de ser pare? I és curable? Un cas diagnosticat d’azoospèrmia es pot tractar en molts casos, i els afectats no han de renunciar del tot a la idea de tenir un fill.
Quin tractament hi ha per a l’azoospèrmia secretora o no obstructiva?
● Si l’azoospèrmia està originada per un problema d’estrès o pel consum actual d’algun fàrmac, de vegades ajuda deixar de l’agent causant, és a dir, reduir l’estrès o deixar de prendre el medicament. De vegades, els testicles tornen a produir espermatozoides de manera normal al cap d’un temps.
● Si la causa originària és un problema hormonal, com en l’hipogonadisme hipogonadotrop, el tractament amb FSH pot ser eficaç perquè els testicles tornin a produir espermatozoides.
● Si el problema és a nivell testicular, l’única alternativa és intentar l’extracció d’espermatozous del testicle. En els casos d’azoospèrmia no obstructiva, la tècnica de TESE (testicular sperm extraction) permet en un 35% dels casos l’obtenció d’espermatozoides que es poden utilitzar amb tècniques de fecundació in vitro. La taxa d’èxit de la tècnica micro-TESE (amb microscopi quirúrgic) pot pujar fins a un 60%. Això no obstant, si per cap dels mètodes es poden obtenir espermatozoides, l’única opció és utilitzar semen de donant o l’adopció.
Quin tractament hi ha per a l’azoospèrmia obstructiva?
El pronòstic reproductiu a les azoospèrmies obstructives és bo. Principalment, hi ha dues opcions:
● La reparació quirúrgica per resoldre l’obstrucció i unir els conductes (vasovasostomia, vasoepididimostomia i resecció transuretral de conductes ejaculadors).
● Extracció d’espermatozoides del testicle (TESE) o de l’epidídim (PESA), en cas que no sigui possible la reparació quirúrgica. La taxa d’èxit de recuperació espermàtica per a FIV/ICSI se situa gairebé en un 100%.
Es pot prevenir l’azoospèrmia?
Algunes causes de l’azoospèrmia es poden prevenir. La qualitat de l’esperma es pot millorar amb un estil de vida saludable. Per tant, evita l’alcohol, les cigarretes, les drogues i la radiació.
Si has de prendre medicació durant un període de temps prolongat que pugui afectar la qualitat de l’esperma o sotmetre’t a tractaments de radioteràpia o quimioteràpia, hi ha la possibilitat de congelar l’esperma i emmagatzemar-lo en llocs adequats per a un desig posterior de tenir fills.
L’azoospèrmia, una afecció amb múltiples causes que pot tenir solució
En resum:
● L’azoospèrmia és un trastorn que afecta el 15% dels homes infèrtils.
● Les causes de l’azoospèrmia són variades i de vegades un estudi genètic complet (exoma o genoma) pot determinar la causa del problema. Aquest fet és important per les nombroses implicacions que té, entre les quals destaquen la possibilitat que variants genètiques implicades en la infertilitat masculina també puguin afectar la salut general del pacient i fins i tot puguin tenir implicacions per a la salut reproductiva i general de la descendència. A més, algunes variants ja tenen un valor pronòstic per a la recuperació d’esperma testicular.
● La pregunta principal que es fan els pacients azoospèrmics o les seves parelles de si podran aconseguir un embaràs i ser pares, no té una resposta definitiva. Dependrà de la causa de l’azoospèrmia i de la possibilitat d’obtenir espermatozoides al testicle per ser utilitzats amb tècniques de reproducció assistida.
A Genosalut oferim tant els estudis genètics clàssics per analitzar les causes de la infertilitat com els estudis genètics avançats (exoma).
Si t'agrada el nostre blog, subscriu-te al nostre newsletter.


