¿Qué es la azoospermia?
Los médicos hablan de azoospermia cuando no se encuentran espermatozoides en el semen. Los hombres con azoospermia son infértiles. No obstante, los afectados no tienen que abandonar por completo su deseo de ser padres, hay procedimientos que hacen posible conseguir un embarazo, tales como la terapia hormonal o la realización de una biopsia testicular para la extracción de espermatozoides que pueden ser utilizados para la reproducción asistida.
A continuación, os contamos todo lo que necesitáis saber sobre la azoospermia: diagnóstico, causas y opciones de tratamiento.
¿Cuántos hombres padecen azoospermia?
Por lo que se refiere a los números, se estima que afecta hasta el 1% de todos los hombres y entre el 10% y 15% de los hombres de las parejas infértiles.
¿Cuáles son los síntomas de la azoospermia?
Por norma general, la azoospermia es un trastorno que no presenta ningún síntoma perceptible. Los hombres afectados no suelen tener quejas y sólo cuando surge el deseo de tener un hijo y no se cumple, se dan cuenta de que algo va mal.
No obstante, en algunos hombres, un problema de base, como una anomalía cromosómica, un desequilibrio hormonal, venas testiculares dilatadas o una afección que obstruye el paso de los espermatozoides sí que pueden causar ciertos signos y síntomas. Así, por ejemplo, los hombres con síndrome de Klinefelter (que en un 90% de los casos padecen azoospermia) pueden tener una serie de problemas generales de salud tales como: síndrome metabólico, enfermedades autoinmunes, tromboembolismos, trastornos cognitivos o psiquiátricos…
¿Cómo se diagnostica la azoospermia?
En cualquier caso, para el diagnóstico de la azoospermia es necesario en primer lugar la realización de un espermiograma o seminograma. Esta prueba permite analizar en detalle el contenido seminal y determinar la calidad del esperma (concentración, cantidad, morfología y movilidad de los espermatozoides). Se trata de un primer examen a la hora de valorar la infertilidad masculina, pero en ningún caso es un test definitivo de fertilidad.
Por lo que se refiere a la concentración de los espermatozoides, los valores se comparan con aquellos de referencia de la Organización Mundial de la Salud (OMS) y se establece un diagnóstico:
● Azoospermia: no se hallan espermatozoides en la muestra fresca y tampoco tras centrifugación de la misma.
● Criptozoospermia: no se hallan espermatozoides en la muestra fresca pero sí tras centrifugación de la misma.
● Oligospermia: la concentración de espermatozoides en el eyaculado es inferior a 15 millones por mililitro.
● Normozoospermia: ningún parámetro seminal alterado. La muestra seminal está dentro de la normalidad.
Para poder diagnosticar la azoospermia con seguridad y evitar errores analíticos, la OMS recomienda realizar dos seminogramas con dos-tres meses de intervalo entre uno y otro. De esta forma, se puede descartar que la ausencia de espermatozoides en la primera muestra se debe a factores como estrés, mala alimentación, toma de medicamentos, fiebre, etc. Si en el segundo seminograma el resultado del recuento de espermatozoides es de nuevo cero, se confirma el diagnóstico de azoospermia.
¿Cuáles son los tipos de azoospermia?
La azoospermia suele clasificarse en dos grandes grupos:
● Azoospermia secretora o no obstructiva: cuando existen problemas hormonales o funcionales de los testículos a la hora de producir espermatozoides (espermatogénesis).
● Azoospermia obstructiva: cuando se producen espermatozoides, pero no pueden ser expulsados en el eyaculado por una obstrucción o ausencia de los conductos que salen de los testículos.
Por lo que respecta a las causas, son varias las que se esconden detrás de la azoospermia. A grandes rasgos, puede tratarse de una azoospermia congénita (es decir, que se padece desde el nacimiento, bien por causas genéticas u otras) o adquirida (generalmente por factores externos como sustancias tóxicas, fármacos, traumatismos…) A veces, no es posible identificar la causa y se habla de azoospermia idiopática.
A continuación, os detallamos las principales causas de la azoospermia no obstructiva y la azoospermia obstructiva.
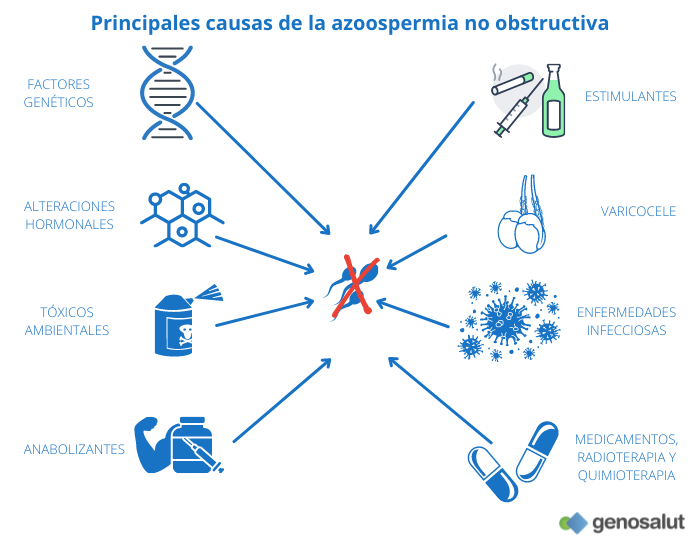
¿Cuáles son las principales causas de la azoospermia secretora o no obstructiva?
Las causas de la azoospermia no obstructiva son variadas y van desde alteraciones hormonales, hasta daños orgánicos y alteraciones genéticas. Entre los desencadenantes se encuentran:
● Anomalías genéticas: microdeleciones del cromosoma Y, anomalías cromosómicas numéricas (síndrome de Klinefelter), anomalías cromosómicas estructurales (alteraciones del cromosoma Y con cromosomas Y isodicéntricos, truncados o en anillo o anomalías en los autosomas del tipo translocaciones robertsonianas, translocaciones recíprocas e inversiones), síndrome del varón 46, XX, mutaciones en determinados genes (CFTR, ADGRG2, AR, TEX11…)
● Estimulantes como el alcohol, los cigarrillos o las drogas.
● Tóxicos ambientales como pesticidas, metales pesados o disolventes.
● Tratamientos contra el cáncer (radioterapia y quimioterapia).
● Determinados fármacos, como, por ejemplo, la cimetidina y la sulfasalazina.
● Consumo de anabolizantes.
Todos los hombres que quieren acentuar su fuerza muscular tomando esteroides anabólicos deben tener en cuenta que estas sustancias provocan una fuerte disminución de la autoproducción de las hormonas necesarias para la producción de espermatozoides (FSH y LH), lo que conlleva una disminución de la producción de los mismos. Incluso después de años de abuso, lo único que ayuda es la medicación para potenciar las hormonas.
● Enfermedades sistémicas graves como, por ejemplo, la insuficiencia renal o hepática severa.
● Infecciones tales como el virus de las paperas que pueden provocar la inflamación de los testículos (orquitis). Esta inflamación puede perjudicar temporal o permanentemente el desarrollo de los espermatozoides.
● Varicocele severo.
● Alteraciones hormonales, como el hipogonadismo hipogonadotropo (deficiencia de las hormonas liberadas por la hipófisis y encargadas de estimular la producción espermática en los testículos). Puede deberse a una alteración congénita (síndrome de Kallman), a un tumor hipofisario, o a la toma de esteroides anabolizantes que suprimen la función hipofisaria.
● Ausencia congénita de testículos (anorquia).
● Anomalías del descenso de los testículos (criptorquidia) durante el desarrollo embrionario, que quedan escondidos en la ingle o en el abdomen. Normalmente se detecta al nacer y se suele operar a una edad temprana. No obstante, en las criptorquidias bilaterales la mayoría de los varones son azoospérmicos a pesar de haberse sometido a la operación.
● Idiopática: de causa desconocida.
¿Cuáles son las principales causas de la azoospermia obstructiva?
En este tipo de azoospermia los testículos funcionan de forma correcta, pero los espermatozoides no pueden llegar al eyaculado. Para que exista una azoospermia se requiere una obstrucción bilateral de la vía seminal, bien sea por causas congénitas o adquiridas (infecciones, operaciones, traumatismos).
● Obstrucción de ambos conductos deferentes: congénita (ABCD, agenesia bilateral de conductos deferentes) o adquirida (vasectomía, cirugía bilateral de hernia inguinal, determinadas infecciones como la gonorrea).
● Obstrucción de ambos conductos eyaculadores: congénita (quistes müllerianos) o adquirida (tras una prostatitis).
● Obstrucción de ambos epidídimos: congénita o adquirida (después de una epididimitis, de un traumatismo o de cirugía escrotal).
¿Cómo se diagnostica el tipo de azoospermia?
Una vez establecido el diagnóstico de azoospermia en base a los resultados del seminograma, existen otras pruebas y análisis que pueden servir para determinar el tipo concreto de azoospermia, secretora o obstructiva. Entre ellos se encuentran: la anamnesis, el análisis hormonal, la exploración física, el estudio genético y la biopsia testicular.
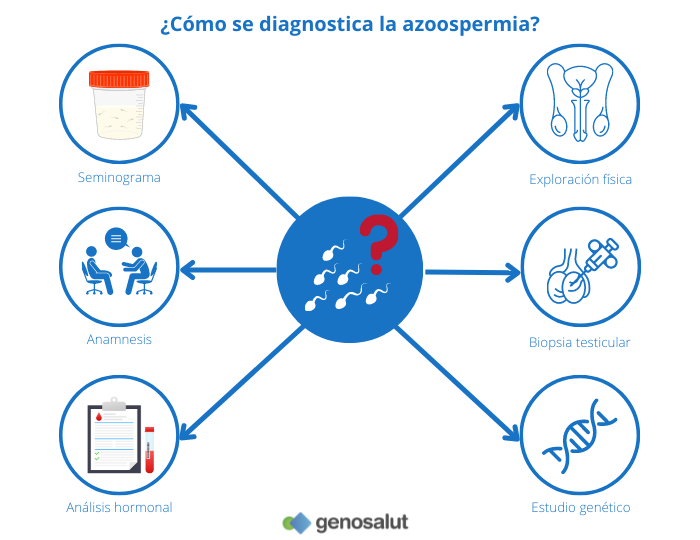
Anamnesis o historia clínica
Si bien la anamnesis se realiza al principio de una consulta por problemas de fertilidad, una vez se tiene el resultado de azoospermia en base al seminograma, se puede refrendar, profundizar o completar con preguntas dirigidas a este tipo de afección. Estas preguntas harán referencia a: tratamientos con radioterapia o quimioterapia, exposición a pesticidas y toxinas, toma de esteroides anabolizantes, haber sufrido determinadas enfermedades (virus de las paperas, tumor testicular, ETS, varicocele, hidrocele…), traumatismos en los testículos, historial de fertilidad en la familia…
Análisis hormonal
La producción de espermatozoides está regulada por hormonas, entre las que se encuentran la testosterona y la FSH (hormona foliculoestimulante). Alteraciones en el equilibrio del sistema endocrino (hormonal) pueden alterar la espermatogénesis y llegar a impedir la liberación de espermatozoides. De la misma forma, alteraciones en la espermatogénesis pueden causar desequilibrios hormonales.
El análisis de estas dos hormonas puede servir, en ocasiones, para determinar el tipo de azoospermia.
● FSH: Esta hormona se produce en la hipófisis (glándula de la base del cerebro) y su función principal es estimular la producción de espermatozoides en el testículo.
Fallos en la espermatogénesis provocan el aumento de la FSH como respuesta del organismo en un intento de estimular más los túbulos seminíferos para restablecer la normalidad. En las azoospermias no obstructivas el valor de la FSH puede estar elevado, en las azoospermias obstructivas el valor de la FSH suele ser normal, y en algunas enfermedades de la hipófisis la FSH está disminuida (como el hipogonadismo hipogonadotropo).
● Testosterona: Esta hormona, producida en el testículo, sigue el patrón contrario a la FSH. En caso de fallos en la espermatogénesis (azoospermia), los pacientes presentan niveles de testosterona más bajos de lo habitual.
Valores altos de FSH y bajos de testosterona son indicativos de azoospermia no obstructiva o secretora. Es decir, la ausencia de espermatozoides se debe a la falta de producción de los mismos, a alteraciones en la espermatogénesis.
Por el contrario, valores hormonales normales son indicativos de azoospermia obstructiva. Generalmente la obstrucción aparece a nivel de epidídimo o de los conductos deferentes.
Exploración física
La exploración física incluye la palpación de los testículos (para buscar bultos y evaluar su tamaño y posición), de los epidídimos, y de los conductos deferentes. También hay que descartar la presencia de un varicocele de tamaño significativo.
No obstante, la distinción entre azoospermia no obstructiva y obstructiva es difícil en base a los exámenes mencionados. Ni la exploración física (palpación de los conductos deferentes y medición del volumen testicular) ni los análisis de laboratorio (niveles hormonales) o una combinación de ellos permiten establecer con seguridad el diagnóstico.
Si los resultados no son concluyentes o si no se encuentra ninguno de estos hallazgos adicionales es imposible saber si se trata de una azoospermia obstructiva o no obstructiva. El diagnóstico lo proporciona una biopsia testicular.
Biopsia testicular
En los hombres con azoospermia, el diagnóstico definitivo (aunque meramente descriptivo y no causal) sólo puede determinarse mediante una biopsia testicular, que suele realizarse (mediante extracción de esperma testicular, TESE o micro-TESE) en el mismo acto quirúrgico que la obtención de espermatozoides para fecundación in vitro (FIV).
Los resultados que se pueden obtener son los siguientes:
● Atrofia mixta: túbulos con diferentes estadios de espermatogénesis.
● Diversos tipos de bloqueo durante la espermatogénesis: bloqueo meiótico, espermátida redonda…
● Síndrome de Sertoli (SCOS, Sertolli Cell Only Syndrome) en el que los túbulos no contienen ninguna célula germinal.
Estos fenotipos pueden ser globales (presentes en todos los túbulos) o focales, con un porcentaje variable de túbulos que muestran varias etapas de espermatogénesis limitada a nivel cuantitativo y cualitativo.
Como hemos indicado, todas las categorías son descriptivas. Es decir, simplemente ayudan a clasificar el «factor masculino» en la infertilidad de la pareja, pero no ofrecen ningún diagnóstico causal de la alteración de la espermatogénesis o de las causas de obstrucción en los hombres afectados.
Para determinar la causa de la azoospermia, una herramienta valiosa son los diferentes análisis genéticos, en concreto los estudios genéticos avanzados como el exoma y el genoma.
Estudio genético clásico
El diagnóstico genético en pacientes azoospérmicos se ha estancado desde hace décadas en unos estudios básicos. Si bien ofrecen una respuesta en aprox. el 20% de los casos, se sabe actualmente que la influencia de la genética en este tipo de pacientes es mucho mayor.
Hasta la fecha, las pruebas genéticas indicadas en casos de azoospermia suelen ser:
● Cariotipo: para descartar el síndrome de Klinefelter.
Los varones con síndrome de Klinefelter tienen, por norma general, un cromosoma X extra, es decir su cariotipo es 47, XXY. No obstante, también hay casos con 2 ó 3 cromosomas X extra (48, XXXY y 49, XXXXY respectivamente). La frecuencia estimada de este síndrome es de 1 de cada 600 varones en la población general, mientras que en los pacientes con azoospermia no obstructiva llega a ser de 1 de cada 7. Son varones con testículos pequeños y firmes, más del 90% padecen azoospermia y el resto criptozoospermia u oligospermia severa.
La posibilidad de ser padres para estos pacientes depende en gran medida de dos factores: la edad y el grado de mosaicismo. Las técnicas de reproducción asistida (TESE y especialmente micro-TESE) permiten recuperar espermatozoides testiculares en pacientes con síndrome de Klinefelter que son azoospérmicos, siendo las tasas de éxito mejores en los hombres menores de 31 años.
● Estudio de las microdeleciones del cromosoma Y: para descartar la presencia de deleciones en la región AZF.
Los hombres pueden presentar desde una oligospermia severa hasta una azoospermia en función de la localización y de la extensión del fragmento perdido. No obstante, incluso en los casos de azoospermia, los hombres afectados pueden tener hijos biológicos mediante TESE seguido de ICSI. Hay que tener en cuenta, que la deleción se transmitirá obligatoriamente a los hijos varones y que por lo tanto tendrán también que recurrir a técnicas de fecundación asistida para ser padres.
Dado que se ha descrito una disminución progresiva de la producción de esperma en los hombres con síndrome de Klinefelter y deleción de AZFc, la criopreservación preventiva de espermatozoides en la edad adulta joven es una opción viable para la preservación de la fertilidad.
● Mutaciones en el gen CFTR: los casos de azoospermia obstructiva son debidos en hasta un 80% de los casos a la ausencia de conductos deferentes la causa es una mutación en el gen CFTR. Prácticamente el 100% de estos pacientes pueden ser padres extrayendo los espermatozoides del testículo o epidídimo y utilizándolos con fecundación in vitro.
No obstante, dado que la frecuencia de portadores de mutaciones de CFTR en personas de ascendencia europea es elevada (1 de cada 25), es obligatorio el cribado de la pareja para evaluar el riesgo de dar a luz a un niño afectado por la fibrosis quística. Si ambos progenitores son portadores, debe realizarse un diagnóstico prenatal o un DGP.
Como hemos indicado al principio de este apartado, es ya sabido que la influencia de la genética en la infertilidad masculina es mucho mayor. Es decir, con los estudios genéticos clásicos muchos pacientes azoospérmicos nunca conocerán la causa de su afección. En ocasiones, para dar respuesta a la causa del problema de fertilidad puede servir la realización de un estudio genético avanzado.
Estudio genético avanzado
Los avances tecnológicos y científicos de los últimos años han permitido identificar más de 100 mutaciones genéticas asociadas con infertilidad y azoospermia. Por ello, la realización de un análisis genético global, como el exoma o el genoma, que detecte tanto los factores genéticos “clásicos” estudiados hasta el momento (síndrome de Klinefelter, microdeleciones del cromosoma Y, mutaciones en el gen CTFR), como las nuevas mutaciones detectadas en los últimos años es una herramienta que puede contribuir a la determinación de la causa de la azoospermia.
Aparte de su implicación directa en la fertilidad del paciente, el conocimiento de las causas genéticas de la infertilidad es importante por otros motivos:
● Las variantes genéticas implicadas en la infertilidad masculina también pueden afectar a la salud general
● Las variantes genéticas relacionadas con infertilidad pueden tener implicaciones para la salud reproductiva y general de la descendencia
● Mejora la toma de decisiones clínicas: Mutaciones en determinados genes tienen ya un valor pronóstico para la recuperación de esperma testicular. Por ejemplo, mutaciones en el gen TEX11 están asociadas a ningún éxito en la recuperación de espermatozoides mediante TESE o micro-TESE.
● La identificación de algunas variantes genéticas puede ayudar a personalizar las terapias hormonales (farmacogenética) en un futuro próximo
● Mejora el consejo genético: Permite recomendar el tratamiento más indicado para conseguir un embarazo de éxito
En Genosalut tenemos más de 10 años de experiencia en la realización e interpretación de exomas y genomas para el diagnóstico clínico.
¿Un hombre con azoospermia es capaz de ser padre? ¿Y es curable? Un caso diagnosticado de azoospermia puede tratarse en muchos casos, y los afectados no tienen que renunciar por completo a la idea de tener un hijo.
¿Qué tratamiento existe para la azoospermia secretora o no obstructiva?
● Si la azoospermia está originada por un problema de estrés o por el consumo actual de algún fármaco, en ocasiones ayuda dejar de lado el agente causante, es decir, reducir el estrés o dejar de tomar el medicamento. A veces, los testículos vuelven a producir espermatozoides de forma normal al cabo de un tiempo.
● Si la causa originaria es un problema hormonal, como en el hipogonadismo hipogonadotropo, el tratamiento con FSH puede ser eficaz para que los testículos vuelvan a producir espermatozoides.
● Si el problema es a nivel testicular, la única alternativa es intentar la extracción de espermatozoides del testículo. En los casos de azoospermia no obstructiva, la técnica de TESE (testicular sperm extraction) permite en un 35% de los casos la obtención de espermatozoides que se pueden utilizar con técnicas de fecundación in vitro. La tase de éxito de la técnica micro-TESE (con microscopio quirúrgico) puede subir hasta un 60%. No obstante, si por ninguno de los métodos se pueden obtener espermatozoides, la única opción es utilizar semen de donante o la adopción.
¿Qué tratamiento existe para la azoospermia obstructiva?
El pronóstico reproductivo en las azoospermias obstructivas es bueno. Principalmente, existen dos opciones:
● La reparación quirúrgica para solventar la obstrucción y unir los conductos (vasovasostomía, vasoepididimostomía y resección transuretral de conductos eyaculadores).
● Extracción de espermatozoides del testículo (TESE) o del epidídimo (PESA), en caso que no sea posible la reparación quirúrgica. La tase de éxito de recuperación espermática para FIV/ICSI se sitúa en casi un 100%.
¿Puede prevenirse la azoospermia?
Algunas causas de la azoospermia pueden prevenirse. La calidad del esperma puede mejorarse con un estilo de vida saludable. Por lo tanto, evita el alcohol, los cigarrillos, las drogas y la radiación.
Si tienes que tomar medicación durante un periodo de tiempo prolongado que pueda afectar a la calidad del esperma o someterte a tratamientos de radioterapia o quimioterapia, existe la posibilidad de congelar el esperma y almacenarlo en lugares adecuados para un posterior deseo de tener hijos.
La azoospermia, una afección con múltiples causas que puede tener solución
En resumen:
● La azoospermia es un trastorno que afecta al 15% de los varones infértiles.
● Las causas de la azoospermia son variadas y en ocasiones un estudio genético completo (exoma o genoma) puede determinar la causa del problema. Este hecho es importante por las numerosas implicaciones que tiene, entre las que destacan la posibilidad de que variantes genéticas implicadas en la infertilidad masculina también puedan afectar a la salud general del paciente e incluso puedan tener implicaciones para la salud reproductiva y general de la descendencia. Además, algunas variantes tienen ya un valor pronóstico para la recuperación de esperma testicular.
● La pregunta principal que se hacen los pacientes azoospérmicos o sus parejas de si van a poder conseguir un embarazo y ser padres, no tiene una respuesta definitiva. Dependerá de la causa de la azoospermia y de la posibilidad de obtener espermatozoides en el testículo para ser utilizados con técnicas de reproducción asistida.
En Genosalut ofrecemos tanto los estudios genéticos convencionales para analizar la causa de la infertilidad como los estudios genéticos avanzados (exoma).
Si te gusta nuestro blog, suscríbete a nuestro newsletter


